LISTE ET CLASSIFICATION DES MALADIES AUTO-IMMUNES
Qu'est ce qu'une maladie auto-immune ?

L'essentiel sur les maladies auto-immunes
Qu’est ce qu’une maladie auto-immune ? S’il fallait donner une définition d’une maladie auto immune, on pourrait dire que le concept de « maladies auto-immunes » regroupe un ensemble d’au moins 80 maladies caractérisées par une réaction inappropriée du système immunitaire vis-à-vis des constituants du soi (rupture de la tolérance au soi), passant par exemple par la production d’auto-anticorps qui attaquent ses propres tissus.
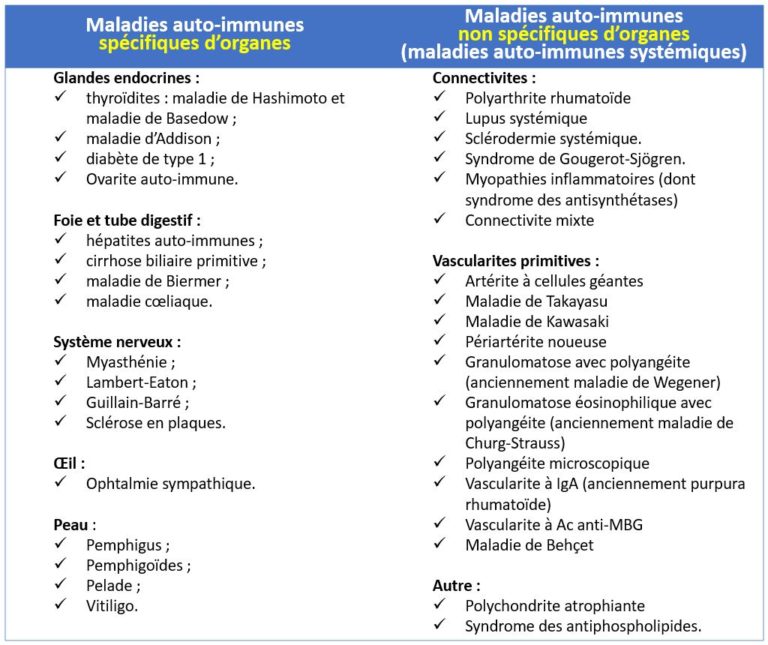
On distingue classiquement les maladies auto-immunes spécifiques d’organes (par exemple les maladies auto-immunes de la peau, de la thyroïde, du poumon, du foie ou de l’intestin, telles que le diabète de type 1 ou la sclérose en plaque), et les maladies auto-immunes non spécifiques d’organes également appelées maladies auto-immunes systémiques, qui peuvent comporter de nombreuses manifestations dont les arthrites (qui peuvent se voir au cours de connectivites telles que la polyarthrite rhumatoïde, le lupus systémique, la sclérodermie, les myosites, ou au cours des vascularites, etc.).
Les maladies auto-immunes sont souvent inflammatoires, mais doivent être distinguées des maladies auto-inflammatoires, dont les mécanismes sont très différents. Quelques très rares maladies auto-immunes ont une origine monogénique : dans ce cas, la mutation d’un seul gène est responsable de la pathologie, mais le plus souvent il s’agit de maladies multifactorielles.
La fréquence (prévalence) des maladies auto-immunes est très variable d’une pathologie à l’autre, mais prises ensembles elles concernent environ 10% de la population des pays industrialisés, et ce chiffre est en constante augmentation au cours des dernières décennies.
Les causes des maladies auto-immunes ne sont pas parfaitement comprises, mais les progrès spectaculaires réalisés dans le diagnostic et le traitement des maladies auto-immunes et notamment dans les nouvelles stratégies thérapeutiques telles que les immunothérapies et traitements ciblés ont permis un allongement spectaculaire de l’espérance de vie. Ces maladies peuvent se soigner mais pas se guérir, et il n’existe pas à proprement parler de booster du système immunitaire. Cependant, ces maladies sont très rarement mortelles.
Ceci conduit à l’émergence de problématiques nouvelles pour le médecin spécialiste : à côté du contrôle de l’activité de la maladie, la prévention de l’atteinte des organes nobles, l’amélioration de la qualité de vie, le maintien de l’insertion professionnelle, et la lutte contre les comorbidités sont devenues des problématiques centrales.
De la tolérance immunologique à la rupture de tolérance
Le système immunitaire a une fonction de reconnaissance de l’environnement exogène et endogène. Les lymphocytes B et les lymphocytes T sont programmés pour reconnaître spécifiquement des antigènes par des récepteurs spécifiques. Compte tenu de l’extrême diversité de ces récepteurs, l’apparition de lymphocytes reconnaissant des antigènes du soi est statistiquement inéluctable. Ces cellules auto-réactives sont contrôlées par les mécanismes de tolérance, cette dernière étant définie par la capacité du système immunitaire à ne pas s’activer vis-à-vis des antigènes du soi (auto-antigènes).
Il existe une auto-immunité physiologique, mais l’autoimmunité pathologique est le résultat d’une rupture de la tolérance immunologique qui survient lors de modifications qualitatives ou quantitatives de l’activité et/ou de la régulation des cellules du système immunitaire et/ou des auto-antigènes. Cette rupture de tolérance peut être acquise ou résulter d’anomalies génétiques de la maturation du système immunitaire. Il est intéressant de préciser que de nombreuses espèces animales, comme le chien, peuvent développer des maladies auto-immunes.

Classification et liste des maladies auto-immunes
Les maladies auto-immunes peuvent être schématiquement divisées en maladies auto-immunes spécifiques d’organes (diabète type 1, sclérose en plaque, thyroïdite de Hashimoto, etc…) ou en maladies auto-immunes non spécifiques d’organes (lupus systémique, sclérodermie, myosite, polyarthrite rhumatoïde, etc), encore appelées maladies auto-immunes systémiques. Concernant les maladies auto-immunes systémiques, on distingue traditionnellement le groupe des connectivites de celui des vascularites, sachant que cette distinction un peu artificielle car une authentique vascularite peut-être présente au cours de certaines connectivites telles que le lupus. D’autre maladies comme les spondylarthrites (spondylarthrite ankylosante) sont souvent citées par erreur, mais ne sont en réalité pas des maladies auto-immunes.
Fréquence des principales maladies auto-immunes
De façon générale, les maladies auto-immunes s’observent préférentiellement chez la femme, mais cela n’est pas vrai pour toutes. Plusieurs hypothèses ont été proposées pour expliquer cette prédominance féminine (rôle des hormones féminines, importances des gènes portés par le chromosome X), mais les causes de celle-ci restent imparfaitement comprises. L’âge de début est variable d’une maladie à l’autre : typiquement deuxième ou troisième décennie pour le lupus systémique, vers l’âge de 40 ou 50 pour la sclérodermie systémique, période post-ménopausique pour la maladie de Sjögren, mais d’une manière générale les maladies auto-immunes peuvent survenir à tout âge, et il existe des formes pédiatriques et des formes « à début tardif ». La prévalence des maladies auto-immunes est très variable d’une pathologie à l’autre: les maladies auto-immunes de la thyroïde sont très fréquentes dans la population générale, tandis que les vascularites primitives à ANCA sont très rares. Selon la définition Européenne, une maladie est rare lorsque sa prévalence est inférieure à 50/100 000 (c’est-à-dire 1/2000).
Prévalence des principales maladies auto-immunes en France (nombre de cas pour 100 000 habitants)
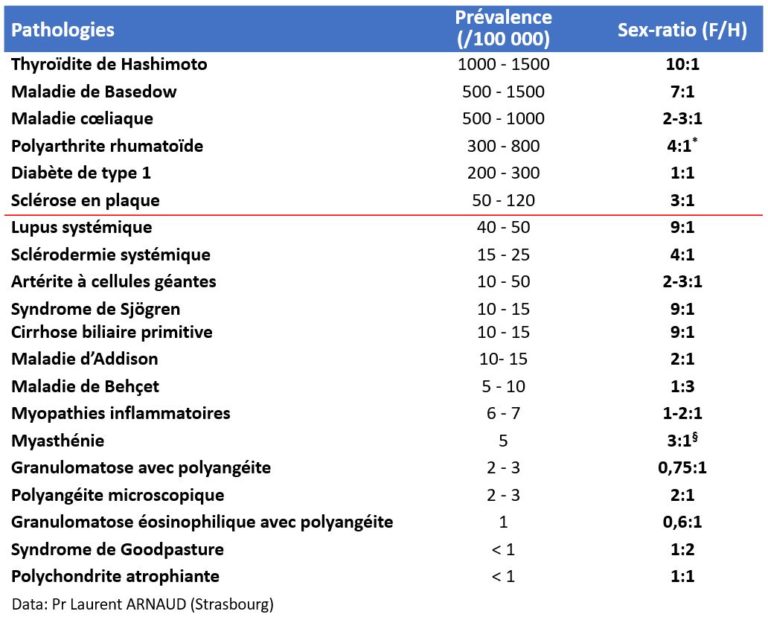
*diminue avec l’âge (en particulier après 70 ans). §Avant 40 ans
Comment attrape-t-on une maladie auto-immune ?
Quels sont les facteurs favorisant les maladies auto-immunes ?
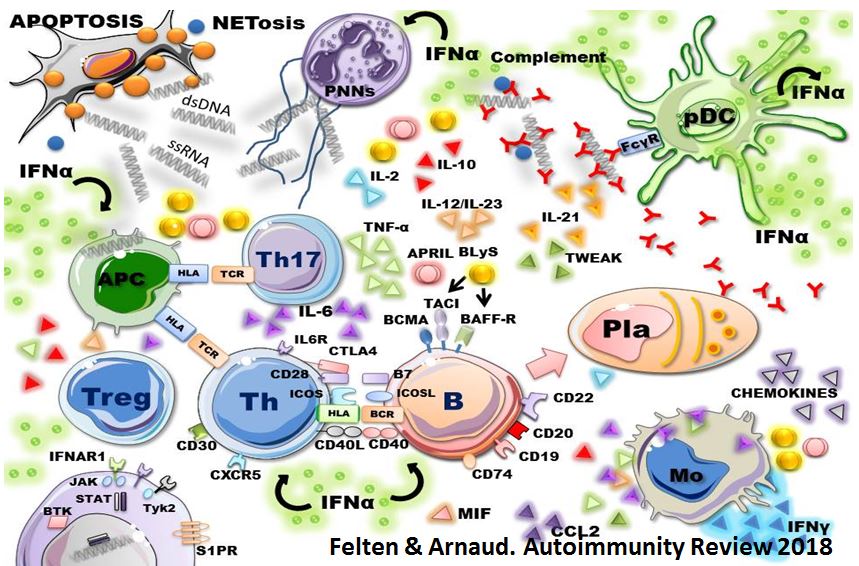
Les maladies auto-immunes sont des pathologies multifactorielles, qui résultent de l’interaction complexe entre un terrain génétique à risque et des facteurs environnementaux favorisants et vont conduire à développer une inflammation chronique. La réaction immunologique implique souvent des auto-anticorps et des lymphocytes T auto-réactifs
Rôle du terrain génétique
L’existence d’une prédisposition ou susceptiblité génétique aux maladies auto-immunes est attestée par l’existence de formes familiales (prédisposition familiale) et par le taux de concordance chez les jumeaux monozygotes. Dans la majorité des cas, les maladies auto-immunes sont dites « polygéniques », car le terrain génétique favorisant ces maladies est déterminé par les polymorphismes de nombreux gènes ne conférant chacun qu’un sur-risque faible à modéré de développer la maladie. Citons par exemple le rôle des gènes du HLA, du complément, des récepteurs des immunoglobulines, des gènes d’activation lymphocytaire et des voies de l’apoptose. Beaucoup plus rarement, les maladies auto-immunes sont monogéniques, car la survenue d’une mutation d’un seul gène suffit à conférer une augmentation très marquée du risque de développer la maladie.

Rôle de l’environnement
De très nombreux facteurs environnementaux pourraient jouer un rôle dans la survenue des maladies auto-immunes. Parfois, l’étude de modèles animaux et des expériences in vitro permettent de confirmer le rôle d’un facteur environnemental (par exemple le rôle délétère des UV au cours du lupus systémique). Des arguments indirects suggèrent que des infections telles que le virus Epstein-Barr ou le cytomégalovirus pourraient jouer un rôle dans le déclenchement de certaines maladies auto-immunes, notamment par des mécanismes de mimétisme moléculaire (similarité entre certaines molécules de ces agents infectieux et des protéines humaines). Le role du microbiote intestinal semble majeur. Le rôle des hormones féminines, en particulier les oestrogènes, est particulièrement important pour certaines maladies auto-immunes telles que le lupus, qui peut également s’aggraver pendant la grossesse ou des poussées se déclencher pendant ou après la grossesse ou l’accouchement. Pour certaines maladies auto-immunes, il existe un gradient géographique (par exemple gradient nord/sud au cours de l’artérite à cellules géantes) qui ne peut se résumer à la seule contribution de facteurs génétiques, et suggère l’implication de facteurs environnementaux. Certains médicaments, comme les anticancéreux inhibiteurs de checkpoint, peuvent induire l’apparition d’auto-anticorps (par exemple des anticorps anti nucléaires) et être responsables d’authentiques maladies auto-immunes (lupus « induit »). L’exposition professionnelle à des substances toxiques mérite aussi d’être soulignée car certaines ont été incriminées dans la survenue des maladies auto-immunes, comme par exemple l’exposition aux particules de silice, qui est associée à un risque accru de développer une sclérodermie systémique, un lupus systémique ou une polyarthrite rhumatoïde. Enfin, le rôle des prothèses mammaires, en particulier au silicone, est très discuté. Le rôle du stress et des causes psychologiques est également discuté chez certains patients.
Quels sont les symptômes des maladies auto-immunes
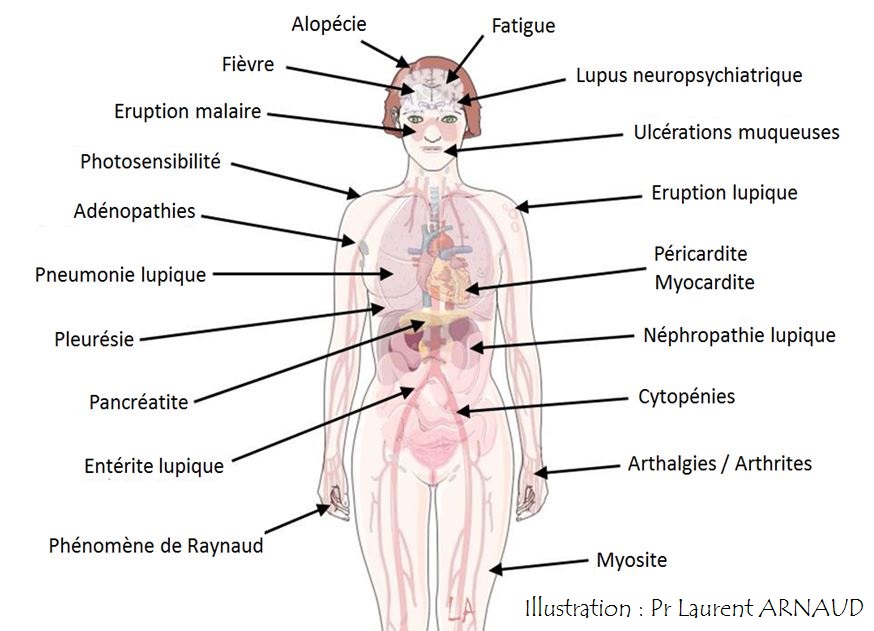
Maladie auto-immune du poumon, du foie, des yeux, du tube digestif, etc…Les symptômes des maladies auto-immunes sont très variés et peuvent comporter de la fatigue, de la fièvre, une altération de l’état général, une perte de cheveux, des éruptions sur la peau du visage et de corps, des douleurs des articulations et des arthrites, une péricardite ou une pleurésie, des douleurs ou faiblesse musculaire, une atteinte des reins (protéines dans les urines), ou du système nerveux central (épilepsie, confusion), etc.
Comment faire le diagnostic de maladie auto-immune ?
Les auto-anticorps
Les autoanticorps sont les principaux marqueurs immunologiques des maladies auto-immunes. La présence d’auto anticorps ne témoigne pas forcément de l’existence d’une maladie auto-immune, puisque toute stimulation du système immunitaire (par exemple au cours des infections) peut conduire à la formation d’auto anticorps. Ces autoanticorps sont surtout utiles pour établir le diagnostic de maladie auto-immune, et seuls certains d’entre eux (par exemple Ac anti-ADN natif et ANCA) sont utiles pour le suivi des patients car ils reflètent l’activité de la maladie. On distingue schématiquement plusieurs catégories d’auto-anticorps utiles pour le diagnostic des maladies auto-immunes : les autoanticorps anti-(antigènes) nucléaires (ANA, parfois abrégé en FAN, pour facteurs antinucléaires) qui sont particulièrement utiles pour le diagnostic des connectivites, les anticorps anti-cytoplasmes de polynucléaires neutrophiles (ANCA) pour le diagnostic de certaines vascularites, les anticorps dirigés contre le fragment constant (Fc) des IgG humaines et/ou animales (facteur rhumatoïde), les anticorps dirigés contre les phospholipides (antiphospholipides) et leurs cofacteurs protéiques (pour le diagnostic du SAPL), et les anticorps anti-tissus au cours des maladies auto-immunes non spécifiques d’organes.
La recherche des anticorps antinucléaires repose sur une stratégie en 2 étapes : le dépistage de ces anticorps, puis la caractérisation de leur cible moléculaire. Le dépistage est généralement réalisé par immunofluorescence indirecte, et permet le cas échéant de préciser le titre (plus grande dilution permettant d’observer la fluorescence), et l’aspect de cette fluorescence (par exemple homogène, mouchetée, centromérique, nucléolaire, etc…), qui a une valeur d’orientation vis-à-vis de la cible des autoanticorps. Rappelons qu’on ne retient comme significatifs que les titres d’ANA ≥1/80ème ou 1/160ème, selon les centres. A cette première étape de dépistage succède la caractérisation des anticorps détectés, permettant de d’identifier leur cible. Cette phase de caractérisation peut faire appel à différentes techniques de laboratoire. En cas de fluorescence homogène, le clinicien demande le plus souvent une recherche d’anticorps anti-ADN double brin (ou ADN natif), dont la présence est très spécifique du lupus systémique, et en cas de fluorescence mouchetée une recherche d’anticorps anti-ENA (Extractable Nuclear Antigens), appellation qui regroupe principalement les anticorps anti-Sm, -RNP, -SSA (Ro), -SS (La), -PM/Scl, -JO1 et -Scl70. Dans la majorité des cas, la recherche des anticorps anti-ENA est déclenchée directement par le laboratoire en présence d’une fluorescence d’aspect évocatrice. En règle générale, la recherche de ces anticorps n’est indiquée que lorsque le dépistage des ANA par immunofluorescence s’est révélé positif. Enfin, il est important de savoir que de nombreux « nouveaux » anticorps ont été décrits ces dernières années, notamment au cours des myopathies inflammatoires et des sclérodermies systémiques ; et qu’il est possible de demander la recherche de ces spécificités antigéniques devant un tableau clinique évocateur.
Anticorps antiphospholipides
Les anticorps antiphospholipides (aPL) représentent une famille d’anticorps dirigés en particulier contre les phosphospholipides des membranes (exemple anticorps anticardiolipines, aCL) ou contre leurs co-facteurs protéiques (β2-glycoprotéine-1, β2GP1). Ce sont les marqueurs-clés du syndrome des antiphospholipides (SAPL). A noter que la recherche d’un anticoagulant circulant s’effectue par des tests d’hémostase (allongement du TCA puis épreuve des mélanges avec plasma témoin), et non par une recherche immunologique. Les aPL sont fréquents au cours du lupus systémique, mais peuvent être présents au cours de nombreuses connectivites.
Facteur rhumatoïde et anticorps anti-CCP.
Le facteur rhumatoïde (FR) est une immunoglobuline, le plus souvent de type IgM, ayant une activité anticorps dirigée contre les immunoglobulines G humaines ou animales. La sensibilité et la spécificité d’une recherche positive de FR dépendent beaucoup du contexte clinique : la sensibilité est d’environ 80 % dans une polyarthrite rhumatoïde évoluant depuis quelques années mais seulement de l’ordre de 30 % au début de la maladie. Rappelons que la présence de FR n’est pas spécifique de la polyarthrite rhumatoïde (spécificité de 60 à 80%), et peut se rencontrer au cours de certaines maladies infectieuses (endocardite, VHC, leishmaniose), d’autres maladies auto-immunes (10 à 20% des patients lupiques, >90% des patients avec syndrome de Sjögren), ainsi que chez les sujets sains, en particuliers âgés (jusqu’à 6-10% de positivité).
Comment se passe le traitement des maladies auto-immunes ?
Avec les progrès thérapeutiques et l’allongement de l’espérance de vie, la prise en charge thérapeutique ne se réduit plus au simple contrôle de l’activité de la maladie (traitement des poussées) et à la prévention des poussées.
Les principaux objectifs thérapeutiques au cours des maladies auto-immunes sont :
| Contrôler l’activité de la maladie |
| Prévenir les poussées |
| Faciliter la conception et la maternité (suivi de la grossesse) |
| Préserver la qualité de vie |
| Préserver l’insertion socio-professionnelle |
| Limiter les séquelles liées à la maladie |
| Limiter les effets secondaires des traitements |
Chaque maladie auto-immune a son schéma thérapeutique propre avec ses indications. En l’absence de traitement étiologique, Le traitement des maladies auto-immunes fait généralement appel à un traitement symptomatique (par exemple le traitement de la douleur), au traitement de la poussée (pour contrôler l’activité de la maladie), par exemple à l’aide de cortisone (corticothérapie) et à des traitements immunosuppresseurs (pour contrôler l’activité de la maladie, permettre l’épargne cortisonique, et prévenir les rechutes), de plus en plus souvent à l’aide d’immunothérapie, biothérapie et de traitements ciblés, dont il existe maintenant des biosimilaires. Dans certains cas, on utilise également un traitement de fond (par exemple hydroxychloroquine au cours du lupus systémique) pour prévenir les poussées. Le traitement des maladies auto-immunes passe aussi par le contrôle des facteurs de risque cardiovasculaires, et par la prévention des complications telles que les infections (notamment par la vaccination). Enfin il ne faudra pas oublier le supplement en vitamine D en cas de carence pour prévenir l’ostéoporose cortico-induite. La recherche est extrêmement active pour découvrir de nouveaux traitements des maladies auto-immunes et préciser les indications de la thérapie cellulaire.

